 |
Parkinson Online Nederland |  |
| [ Home ] | [ Top ] | [ Inleiding ] | [ Behandeling ] | [ Geschiedenis ] | [ Info ] | [ Kandidaat ] | [ Vooronderzoeken ] |
| [ Operatie ] | [ Verblijf ] | [ Batterij ] | [ Risico's ] | [ Genezing ] | [ Vergoeding ] | [ Ervaringen ] | [ Adressen ] | [ Dank ] |
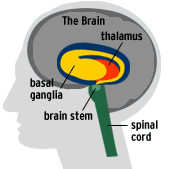
| Diepe hersenstimulatie van de subthalamische nucleus |
Bij wie moet ik zijn als ik in aanmerking wil komen voor een DHS van de STN? In eerste instantie bij de eigen neuroloog. Na overleg met de eigen neuroloog, kan deze je voor een "second opinion" doorsturen naar een van de onderstaande adressen. Als je zelf twijfels blijft houden na een advies van ťťn van deze centra, schroom dan niet om een "third opinion" te vragen bij ťťn van de andere centra. NB 1: het behandelprotocol verschilt van centrum tot centrum. Hoewel het hierboven beschreven behandelprotocol vůůr, tijdens en nŠ de operatie nadrukkelijk wordt aanbevolen door de specialisten, die de meeste ervaring hebben met de DHS van de STN, wordt dit advies niet door alle hierna genoemde centra gevolgd. Informeer dus van te voren naar het behandelprotocol dat wordt gehanteerd in het centrum, waarheen je wordt verwezen. NB 2: een tweede belangrijk verschil tussen de diverse centra is, dat de DHS van de STN in een aantal centra wordt uitgevoerd in het kader van een vergelijkend onderzoek tussen pallidotomie en DHS van de STN, terwijl er ook centra zijn waar je "gewoon" een DHS van de STN kunt krijgen. (Nederlandse telefoonnummers vanuit
BelgiŽ: eerste 0 weg en dan 0031 ervoor)
|
| [ Home ] | [ Top ] | [ Inleiding ] | [ Behandeling ] | [ Geschiedenis ] | [ Info ] | [ Kandidaat ] | [ Vooronderzoeken ] |
| [ Operatie ] | [ Verblijf ] | [ Batterij ] | [ Risico's ] | [ Genezing ] | [ Vergoeding ] | [ Ervaringen ] | [ Adressen ] | [ Dank ] |
| Voor het laatst bijgewerkt op: 29 juni 2000 ; Copyright © Hans van der Genugten |